(三)化学結合の性質
(1)イオン結合と共有結合
うわぐすりは、珪酸塩ガラスの構造でそのだいたいが解りますが、結晶やガラスなど2個以上の原子核を持つ空間での電子の運動は、量子力学分子軌道理論などを用いなければうまく説明されません。これは私達には複雑すぎて実用的ではありませんので、私達は結合の性質を大雑把な近似で理解するようにします。↑
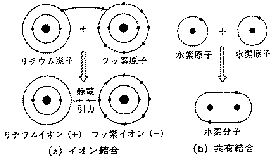
Kosselは、A・B間で、Aの外殻の1〜数個の電子がBに移り、A陽イオン・B陰イオンのような希ガス型電子配置を持ったとき、静電気的に引きあって結合ができるとしました。これが<イオン結合>です。(図表9a)
他方、Lewis は、電子対を共有することで、双方の外殻電子が希ガス型になって結合する<共有結合>のモデルを示しました。(図表9b)↑
←図表9.イオン結合と共有結合のモデル
(2)結合の極性

図表10.共有結合とイオン結合
|
現実の化学結合は<イオン結合>と<共有結合>を両極とする、その中間的なところにあります。イオン結合で、電子を手放して陽イオンになりやすい元素を陽性(金属)元素、電子を受け入れて陰イオンになりやすい元素を陰性(非金属)元素と呼びます。↑
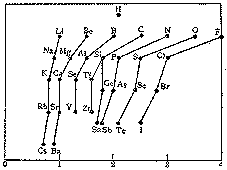
図表11.電気陰性度
Paulingによる |
共有結合の外殻の共有電子対が原子核から受ける力は、同じ元素間では等しいのですが、異なるときは、電子雲が陰性原子の側に偏ります。さらに偏りが大きくなれば、電子雲は陰性元素側に引き寄せられてイオン結合となります。(図表10)
電子雲のこうした偏りを量 るのが、Pauling の<電気陰性度>です。これは「分子内の原子が電子を引きつける力」と定義され、A=B間の結合で、AがBよりも電気陰性度が大きければ、電子雲はA側に引き寄せられることを意味します。(図表11)
一方、Fayansは、イオンの<分極能>によって、イオン結合から共有結合への移行を説明しました。↑
<分極能>は「陽イオンが陰イオンの電子雲を引きつけ分極させる能力」です。この能力が大きいほど結合は共有性を増します。<分極能>
は正電荷が大きく<イオン半径>が小さいものほど大きくなります。↑
(3)<イオン半径>と<配位数>
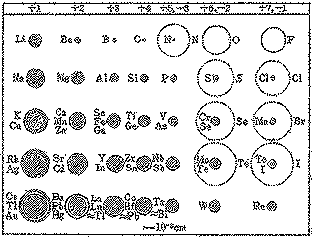 (図表12)単原子イオンの大きさ(『化学結合論』 (図表12)単原子イオンの大きさ(『化学結合論』
FRITZ SEELより)
単原子イオンの大きさ(元素の記号は各列の上段に示した電荷をもつイオンについて。2つ以上の円が示されている場合、イオン半径が小さくなる順↑
|
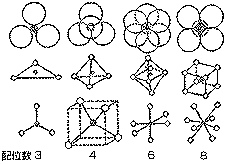
(図表13)小さな陽イオンに対する大きな陰イオン配位
| r+/r- |
配位数
|
配位形状
|
|
0.155〜0.225
0.225〜0.414
0.414〜0.732
0.732〜
|
3
4
6
8 |
正3角形
4面体
8面体
体心立方体 |
(図表14)イオン半径と配位数 |
イオンを一定の半径を持つ球と考えて、その相互作用を考えるとき、この半径を<イオン半径>といいます。<イオン半径>は、周期律中の同族間では、原子番号の増加とともに大きくなり、また、一般
的には、陰イオンは陽イオンよりも大きいものです。(図13)
ガラス中での珪酸SiO2 は、Si4+を中心にして、それを4個のO2-で囲んだ、SiO44-
という正四面 体にまとまっています。
このとき、陽イオンSi4+を囲む陰イオンO2-を<配位子>といい、その数を<配位数>といいます。<配位
子>の数は、ふつう、陽イオンと 陰イオンの大きさによって決まります。(図14)↑
(4)<酸>と<塩基>
| Fe2+<Fe3+ |
| K+
<Na+
<Li+ |
| Na+
<Mg3+<Al3+ |
| →酸性大 |
図表15
酸の強さ
|
Lewis の理論では、電子対を与える物質を<塩基>、電子対を受け入れる物質を<酸>といいます。外殻に一つ以上の空軌道を持つものはこの条件に当てはまりますから、陽イオンは全て<酸>ということになり、逆に、陰イオンは全て<塩基>です。酸・塩基の強さは<電荷>と<イオン半径>によって、つまり、Fayansの<イオン分極>の考えで説明されます。↑
陽イオンの分極能が大きければ、配位子の電子雲をよく吸引する強い酸です。電荷が大きくイオン半径が小さいほど、周期表では左から右へ、下から上へと酸性度が強くなるのです。これは結合が共有性を増していく過程と対応しています。↑
(5)<酸化>と<還元>
電子を失う反応を<酸化>、奪う反応を<還元>といいます。電子は負電荷を持ちますから、電子が失われること<酸化>は、結果的には陽イオンの正電荷が増すこと、陰イオンの負電荷が減ることです。逆に<還元>は陽イオンの正電荷が減ること、陰イオンの負電荷が増えることをいいます。
イオン結合の電荷の数を<酸化数>といいます。単体では酸化数0、共有結合化合物では電子雲の偏りで正負を決めます。それによって<酸化数>の増加が<酸化>、減少が<還元>ということになります。↑
<主な参考文献>
『化学結合論』FRITZ SEEL著、中川一郎訳‥‥東京化学同人
『一般化学』竹林松二著‥‥学術図書出版
『物質の化学構造』アガフォーシン著大竹三郎訳‥‥東京図書
『高火度釉基礎試験』編集発行-釉研究会書記局(1976)
\1600
残部があります。ご注文は下記まで。
郵便振替口座=00870-6-33157 広瀬典丈
e-mail
→1高火度釉に対する考え方 →2うわぐすりの化学 →4珪酸塩ガラスの構造
→5釉式座標による灰釉性状図 →6含鉄灰釉・土石釉の性状図 →7釉式計算の仕方
→8釉式を使った釉調合の方法 →9長石-CaO-BaO-MgO-ZnO系透明釉性状図
→10長石-CaO-BaO-MgO-ZnO系+Fe2O3性状図
|